こんにちは くぅたろう です
技術士二次試験の回答って探しても見当たらないですよね。
総監などの択一式(選択問題)の答えは技術士会のホームページに載っていますが、Ⅱ-1などの計算をやる回答は探してもなかなかインターネットでも見当たりません。
しかも最近「化学」は計算が多くなってきました。
そこで、徒然ですが令和2年度の化学プロセスの計算を載せました。
責任は持てませんが、わからない方の参考になればと思います。
技術士二次試験【化学】の過去問(令和2年度)
全ての問題が計算ではないですが、一部計算ばかりの問題があります。
Ⅱ -1 – 4 の計算
問題はこれです。技術士会HPより

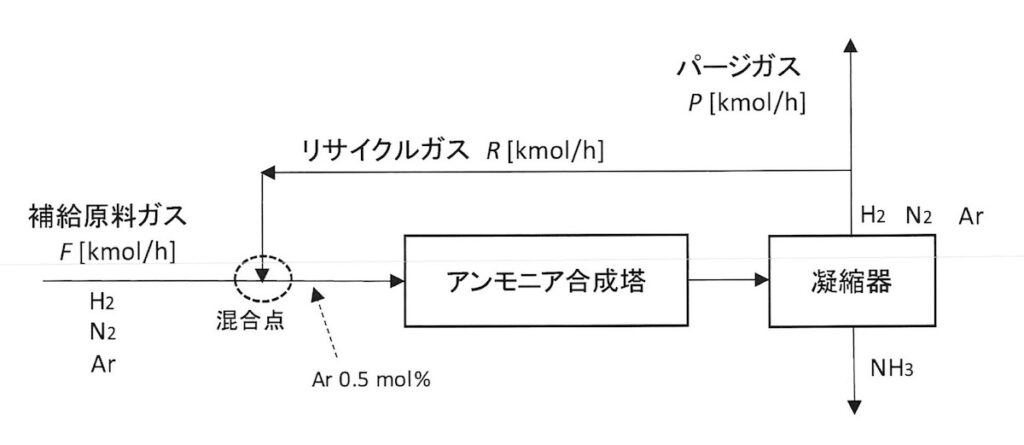
(1)N2とH2の合計流量は、100 [kmol/h]です。
これにArは含まれていませんので、ArをXとして置いたときに次式が成り立ちます。
X / (100+X) x 100 = 0.5 [mol%]
これを解いて
X = 0.503 [kmol/h] です。
(2)N2の12%がNH3になるので 25 [kmol/h]のN2では、3 (=25 x 0.12) のN2と、9 (=3 x 3) のH2を消費して6 [kmolh]のNH3を生成します。
なので、アンモニア合成塔に入る全流量(100.503 kmol/h) から12 (=3+9)を引くと
88.503 [kmol/h] の未反応ガスが出てきます。Arはアンモニアを取り出す際に1molたりとも出ていかないということで、未反応ガスとしてそのまま出てきます。
ということで、計算すると
0.503 / 88.503 x 100 = 0.568 [mol%] です。
(3)補給原料ガスは空気とH2を混合してぶっこんで導入してます。
空気を圧縮する圧力スイング法などで窒素を分離する場合は、窒素純度99.99%くらいにはなるので、N2:Ar = 78.03 : 0.98 というのは多分膜分離とかになるのでしょうか。
それは置いておき、N2:Ar = 78.03 : 0.98 ということなのでこれを使いますが、問題文に「補給原料ガスは、流量Fで量論比 N2 : H2 = 1 : 3 でさらに微量のArを含む混合ガス」とあります。
N2:Ar = 78.03 : 0.98 の比に対して、H2を考慮すると 78.03 x 3 = 234.09 になります。
つまり、比率でいうと以下になります。
0.98 / (78.03 + 234.09 + 0.98 ) x 100 = 0.313 [mol%]
(4)ここで連立方程式です。
補給ガスFとリサイクルガスR に今まで求めた濃度をかけて、アンモニア合成塔入口のArの流量にすると
① F x 0.00313 + R x 0.00568 = 0.503 [kmol/h]
それで、補給ガスFとリサイクルガスR をたすと、これは合成塔に入全流量になりますので、つまり
② F + R = 100.503 [kmol/h] です。
ということで、①と②の連立方程式を解くと、、、
R : 73.725 [kmol/h]
F : 26.773 [kmol/h]
以上からパージガスはRの答えを元に計算すると
88.563 – 73.725 = 14.778 [kmol/h]
よって、14.778 / 88.503 x 100 = 16.7 %
未反応ガスのパージは16.7%やるのです。
以上
ざっと計算しましたが、最終的な答えに責任は持てませんので自己責任の上参考にしていただければと思います。
最後までお読み頂きありがとうございました。







